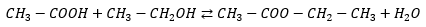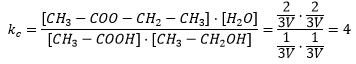He aquí el enunciado: Si calentamos a 50ºC un mol de ácido acético con un mol de etanol hasta alcanzar el equilibrio, vemos que se han formado 2/3 moles de agua. Calcular: 1.- Moles presentes de cada componente en el equilibrio, 2.- Constante de equilibrio del sistema y 3.- Resolver el mismo problema partiendo de 40 g de ácido acético y 34 g de etanol.
Primero vamos a plantear la reacción. Si tenemos en cuenta que mezclamos un ácido con un alcohol, deberemos obtener un éster y agua. Así que el ácido acético con etanol, nos debería producir etanoato de etilo y agua.
Con un simple conteo, podemos ver que la reacción está ajustada, así que seguimos…
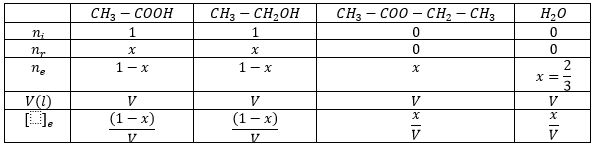
Pongamos todos los datos en una tabla:
Como conocemos el valor de la x, en la tercera fila calculamos los moles de cada componente. Como no sabemos el volumen, no podemos saber las concentraciones, pero no nos la pide el problema.
El valor de la constante será:
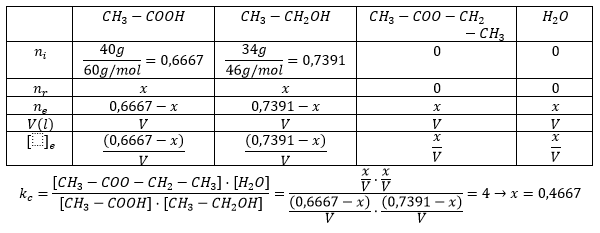
Y para calcular la constante con las condiciones del apartado 3:
Esta vez sí que hemos que convertir las unidades al sistema internacional. Que no se os olvide.