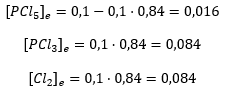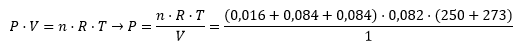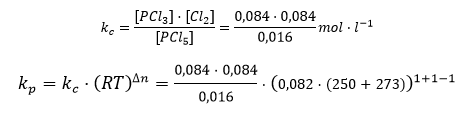Esta vez vamos a incluir el concepto de grado de disociación. No es más que el tanto por uno de los moles totales que reaccionan. Matemáticas otra vez! Ya la hemos liado!
Normalmente estamos más acostumbrados a trabajar con porcentajes. Por ejemplo si te digo que tengo 100 naranjas y te puedes quedar con el 84 por ciento de ellas, lo que quiero decir es que te cojas 84 naranjas y te las lleves, que te las comas o hagas zumo o lo que te venga en gana con ellas. Porque 84% son 84 por cada 100. Si tuviera 200 naranjas, te podrías llevar 84 y 84 porque si tengo 2 veces cien, te puedes llevar dos veces 84. ¿Lo pillas ahora, melón?.
Pues seguimos… si ahora resulta que solo tengo 1, te podrás llevar 0,84 de la naranja (algo más de media pero no una entera). Es decir que 84% es lo mismo que 0,84 por uno. El tanto por uno, se expresa en lugar de por cada 100 unidades se expresa por cada 1 unidad.
Pues resulta que para los problemas de reacciones en equilibrio, el usar el tanto por uno, facilita mucho el cálculo. Sí, nos los toca!, pero es lo que hay. Acostúmbrate!.
El enunciado dice: En un matraz de 1 l se introduce 0,1 moles de pentacloruro de fósforo y se calienta a 250 ºC. En el equilibrio, el grado de disociación es 0,84. El pentacloruro de fósforo se descompone en tricloruro de fósforo y cloro. Calcular: 1.- Presión en el interior del matraz en el equilibrio. 2.- Número de moles de cada componente en el equilibrio. 3.- Valores de Kc y Kp
Analicemos los datos. El volumen donde se hace la reacción es 1 l, se ponen 0,1 moles iniciales de pentacloruro de fósforo y, la reacción se hace a 250ºC. Además nos da el grado de disociación.
Vamos a plasmar la reacción que plantea el enunciado y comprobamos si está ajustada. Asustada, no! Ajustada! Si no sabes lo que es, repasa la teoría y vuelve aquí.
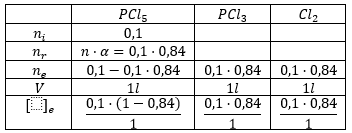
Hagamos una tabla con los moles iniciales, los que reacionan, los del equilibrio, el volumen y la concentración en el equilibrio:
En este caso, el valor numérico de los moles en el equilibrio y sus concentraciones coinciden porque estamos trabajando con un volumen de 1:
No se especifica explícitamente, pero estamos trabajando en modo gaseoso. Somos químicos, deberíamos saber que esa sustancia a 250ºC es un gas. Si no nos queremos complicar la vida, podemos echar mano de la ecuación de los gases que relaciona la presión, volumen, moles, temperatura y una constante de esas tan graciosas que tienen que ver con la física. P·V=n·R·T
En el equilibrio sabemos el volumen, los moles, la temperatura y ¿la constante? Es constante, puñetas! Así que podemos despajar la presión que es lo que nos pide el primer apartado del problema.
Para el segundo apartado, ya lo habíamos calculado en la propia tabla. ¿Lo ves arriba?:.
Para el tercer apartado, debemos saber la definición de las K. Si no, date un repaso de teoría y vuelve:
Nuevamente, como no se me olvidado mirar si las unidades de todas las variables estaban en el sistema internacional, las unidades de todo lo calculado serán en ese sistema. O sí, suerte hemos tenido.