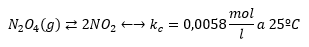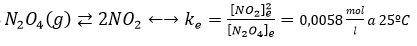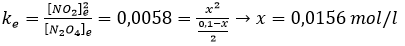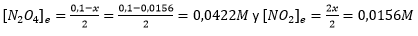Enunciado: Obtener las concentraciones de equilibrio que se alcanzan al introducir 0,1 moles de tetraóxido de dinitrógeno en un matraz de 2 litros a 25ºC teniendo en cuenta la reacción:
En primer lugar, entendamos los datos que nos dan: la cantidad inicial de reactivos, el volumen donde se va a producir la reacción y la temperatura a la que se produce, y la constante de equilibrio. Todas las unidades en las que se expresan las cantidades, son unidades del sistema internacional y son coherentes, es decir, vienen expresadas en las mismas unidades; por lo que no tendremos que hacer ninguna conversión.
En segundo lugar, podemos ver que la reacción indicada está ajustada. Si no sabes qué significa esto, tendrás que repasar algo de teoría de las reacciones químicas antes de seguir. Expresado de una manera muy burda, la cantidad de átomos distintos a la izquierda de la ecuación (estado inicial) debe ser igual a la cantidad a la derecha de la ecuación (estado final).
Veamos qué información podemos sacar de la constante de equilibrio:
Si no recuerdas qué es la constante de equilibrio, repasa algo de teoría de las reacciones químicas. Básicamente es la relación que existe entre las concentraciones de los reactivos iniciales y finales.
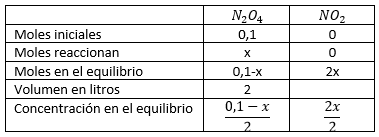
Analicemos lo que sucede en la reacción. Inicialmente, en el matraz de 2 litros ponemos 0,1 moles de tetraóxido de dinitrógeno de los cuales reaccionaran una determinada cantidad que desconocemos y que podemos llamar x.
En el equilibrio quedarán 0,1 – x moles de este compuesto y, según la estequiometría de la reacción (ale! ya te toca repasar también qué es la estequiometría), se habrán generado 2·x moles de dióxido de nitrógeno.
Como el volumen es 2 litros, podemos expresar estas cantidades en términos de concentraciones (¿no sabes qué es la concentración?… pues búscalo y vuelve aquí). La concentración de tetraóxido de dinitrógeno será (0,1-x)/2 y la de dióxido de nitrógeno 2x/2.
Para no perder de vista todos estos datos, hagamos una tabla:
Si volvemos a la constante de equilibrio y cambiamos los valores, podremos despejar el valor de x que desconocíamos. Obtenemos una ecuación de segundo grado de la que se puede obtener el valor de x:
Y sí, en química también se usa mucho las matemáticas. Repasa las ecuaciones de segundo grado.
Finalmente, si miramos en la tabla los valores de las concentraciones en el equilibrio, que es lo que nos pide el problema, tenemos:
Gracias a tener todas la unidades expresadas en el sistema internacional, obtenemos los valores de las concentraciones de Molar (moles/litro). Cuando os den las unidades en otros sistemas o unidades, convertidlas primero y todo será más sencillo.